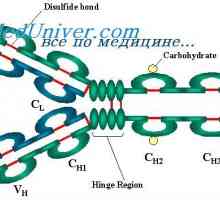
Imunoglobulin struktura g. domene IgG
Kot je znano (Wu, Kabat, 1970), pri čemer primarna struktura ostanki variabilne regije
Vsebina
Na primer, prvi hipervariabilne regijo lahke verige (L1) y Rei protein podolgovat verige, ker Prvič Meg proteinov in je zapakirano v spiralo. Na tej točki v proteina ICRC 603 ima vstavek šest aminokislinskih ostankov, in to področje je podolgovata niso vijačni zanka. V nasprotju ztomu, čeprav z manjšimi odstopanji lokacija okvirja, nevariruyuschih ostankov v različnih področjih, so zelo podobni.
To homologijo v terciarno struktura variabilnih domen To pomeni, da nevariruyuschie ostanki ustvariti tog okvir, ki bi bil upoštevan kot hipervariabilne zanke.
štiri domene (Dveh spremenljivk in dva trajna) tvorita Fab fragmenta. Treba je opozoriti, naslednje vzorce.
1. Oba stalna domena bolj tesno povezana, kar ima za posledico večjo kompaktnost celotnega konstantne regije v primerjavi s spremenljivko. To je zato, ker so konstantne domene interakcijo s štirimi plastmi, ki tvori veliko naležno površino, medtem ko so variabilne domene interakcije treh segmentov vlakna.
2. Osnovna Interakcija med področji sta stranska, m. F., in variabilno in konstantne domene med seboj, medtem ko vzdolžni interakcije (med variabilnimi in konstantno) manj izrazita.
3. Tako težka domena verige, tj. E. VH in CH so v tesnejšem stiku kot dveh svetlobe domeni verige, ki povzroči rahlo upogibanje 'skupno Fab-fragment. Enako upogibanje neločljivo lahka veriga dimera. Slednji je izdelana iz dveh enakih v njihovi primarni strukturi lahkih verig - monomere. Kljub temu, kot med domenami enega monomera znaša 70 °, medtem ko je drugi - 110 °, in da povzroča upogibanje celotne molekule.

Struktura Fc fragmenta označen s tem, da ni tovrstnega upogibanja. Oba EOS domena tesno eden poleg drugega, kot so Cl in CH1 domene v Fab fragmenta, ker CH2 domene ne dotikajo drug drugega, razen kovalentne vezi v gibljivi regiji. Morda ta dogovor CH2 domena je potrebno za njihovo interakcijo s prvo komponento komplementa. Treba je opozoriti, da so rezultati analize rentgenske imunoglobulinov popolnoma v skladu z rezultati, dobljenimi z drugimi metodami prej.
Tako, na primer z optičnim metode - optična rotacijsko disperzije (. Trojica et al, 1971) in infrardečo spektroskopijo izmenjave vodik, devterij (Abaturov SL, 1969..) - je bilo ugotovljeno, da je glavna sestavina sekundarne strukture peptidnih verig imunoglobulinov beta zložljiva.
Poleg tega obstajajo dokazi prikazuje v korist domeni hipotezo (Edelman, 1973). V skladu s to hipotezo, vsak homologna del polipeptidnih verig imunoglobulinov okoli 110 aminokislinskih ostankov v dolžini z enim notranjim disulfidne vezi koagulira v ločenem, relativno neodvisne globuli - domeno. Na primer, svetlobni verige so sestavljene iz dveh domen, gama težka veriga - od štiri.
Video: Video 15 Ig Protitelesa in imunoglobulina Funkcija
Med kroglic so odprte deli polipeptidne verige, posebej občutljivi na proteolitičnih encimov. Ena (od najpomembnejših dokazov strukture domene peptidnih verig imunoglobulinov pravkar postalo mogoče uporabiti protsaz za cepljenje lahkih verig v polovici, ki ni bistveno spremenilo svojo terciarno strukturo primerjavi z native verige. Slednji se je izkazal z optičnimi metodami in raziskave antigenske lastnosti polovici.
Do sredine 60. let so bili smo prejeli zelo razumno podatki, temelji predvsem na preučevanje rekombinacije težkih in lahkih verig in označitev afiniteto, da so aminokislinski ostanki, lahka in težka veriga sodelujejo pri tvorbi aktivne sredini. Pri modelih, ki temeljijo na teh študij rentgenostrukturpyh aktivne FAB-delci namreč razvidno, da je dve verigi tvorijo aktivno stran votlino.
Video: Mielomu bolezen Rustitskogo Calera
Klasične študije Kabat (Kabat, 1976) Karush (Karush, 1962) in Sela (Sela, 1970) od velikosti aktivnega mesta so prav tako dobro ujemajo s študijami uklona rentgenskih fragmentov z dvema mielomske proteinov aktivnosti antigen-vezavni.
 Imunoglobulin lahke verige. organizacija imunoglobulini
Imunoglobulin lahke verige. organizacija imunoglobulini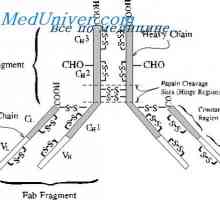 Elektronsko paramagnetno resonanco imunoglobulinov. Struktura IgG (imunoglobulina g)
Elektronsko paramagnetno resonanco imunoglobulinov. Struktura IgG (imunoglobulina g)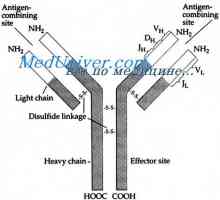 Imunoglobulin središče g. Aktivno Center IgG
Imunoglobulin središče g. Aktivno Center IgG Prilagodljivost imunoglobulina G in e. Fleksibilnosti tipov imunoglobulinov
Prilagodljivost imunoglobulina G in e. Fleksibilnosti tipov imunoglobulinov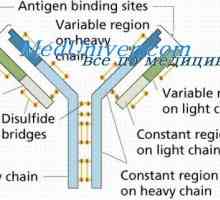 Oborino imunskih kompleksov. Interakcija domene protitelesnih verig
Oborino imunskih kompleksov. Interakcija domene protitelesnih verig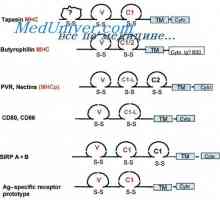 Nadzor izobraževanje imunoglobulinov lahkih verig. Geni lahkih verig protiteles
Nadzor izobraževanje imunoglobulinov lahkih verig. Geni lahkih verig protiteles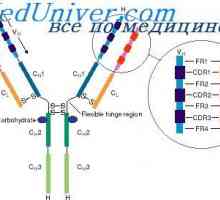 Lokalizacija genov lahkih verig protiteles. Razlogi za variabilnosti svetlobnih verig
Lokalizacija genov lahkih verig protiteles. Razlogi za variabilnosti svetlobnih verig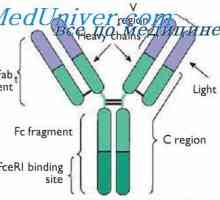 Variabilne regije lahkih protitelesa verig. Variabilne regije genov
Variabilne regije lahkih protitelesa verig. Variabilne regije genov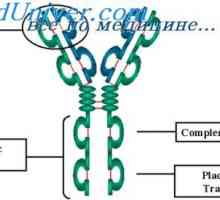 Igrajo lahke imunoglobulin verige. Ekstrauchastki protitelesa
Igrajo lahke imunoglobulin verige. Ekstrauchastki protitelesa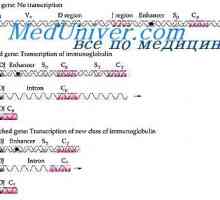 Formacija VC-imunoglobulina gen. Mehanizmi združenje V- in geni protiteles
Formacija VC-imunoglobulina gen. Mehanizmi združenje V- in geni protiteles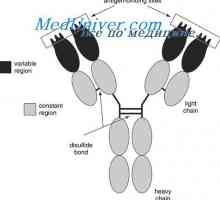 Izobraževanje imunoglobulin. Konstantna regija težke verige protitelesa
Izobraževanje imunoglobulin. Konstantna regija težke verige protitelesa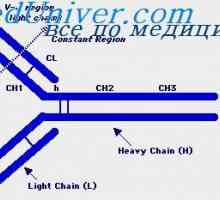 Pritrdilni VH imunoglobulinske geni. Kromosomov z geni protiteles
Pritrdilni VH imunoglobulinske geni. Kromosomov z geni protiteles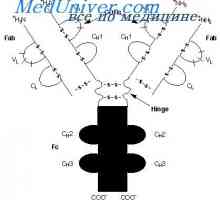 Razlike variabilne regije protitelesa. Spremenljivka imunoglobulin podskupina
Razlike variabilne regije protitelesa. Spremenljivka imunoglobulin podskupina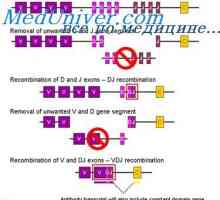 Razporeditev VC-gen. Preklapljanje protitelesa genov aktivnost
Razporeditev VC-gen. Preklapljanje protitelesa genov aktivnost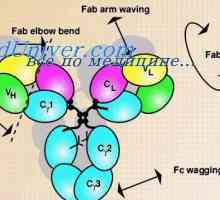 Variabilne regije protitelesa težkih verig. Variabilne regije genov težkih verig
Variabilne regije protitelesa težkih verig. Variabilne regije genov težkih verig Sinteza imunoglobulin težkih in lahkih verig. Enotna sinteza težke in lahke verige protitelesa
Sinteza imunoglobulin težkih in lahkih verig. Enotna sinteza težke in lahke verige protitelesa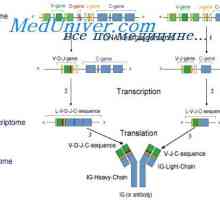 Lastnosti protitelesca mRNA. Strukturo mRNA imunoglobulinov
Lastnosti protitelesca mRNA. Strukturo mRNA imunoglobulinov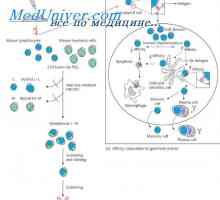 Geni sintezni protitelesa. Število genov, ki sodelujejo pri sintezi imunoglobulinov
Geni sintezni protitelesa. Število genov, ki sodelujejo pri sintezi imunoglobulinov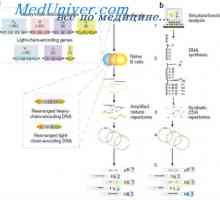 Učinek na fenotip genske aktivnosti. Alelne determinante protiteles
Učinek na fenotip genske aktivnosti. Alelne determinante protiteles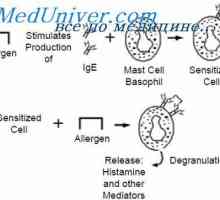 Struktura IgE. Naloge imunoglobulin E
Struktura IgE. Naloge imunoglobulin E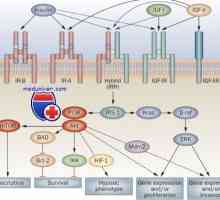 Receptorjev s tirozin kinaze. Receptorji za inzulina in rastnih faktorjev
Receptorjev s tirozin kinaze. Receptorji za inzulina in rastnih faktorjev