Stabilizacija imunoglobulini haptenov. Odvisnost od konformacije protitelesa temperature
Obstajajo podatki iz različnih metode, kaže na povečanje stabilnosti protiteles in njihovih FAB-fragmentov, ki so posledica kompleksov s haptenov. Na primer, dodajanje teh poveča stabilnost hapten molekul denatiruyuschemu delovanja gvanidin hidroklorida (Cathou, Werner, 1970) in k delovanju kemotripsina (Grossberg npr. A., 1965).
IgM Prav tako stabilizirati posebne hapteni glede proteolize z subtilizina in kemotripsina (Ashman, Metzger, 1971). Pokazalo se je, da je znižanje občutljivosti za napad s proteazami IgM celoti zaradi spremembe lastnosti FAB-fragmentov. Po našem modelu, preusmerja komponento A ravnotežje hapten in B Fab-fragment tekme.
Zato, da pojasni praksa dovolj, da se omogoči zgornjih rezultatov, da je prosta energija bolj kompaktna konformacijska Nižji prosta energija konformacijska B (t. e. A-konformacijska stabilen kot B). Če je tako, potem povečanje stabilnosti beljakovin, ne bi smela biti odvisna od tega, kako ustrezno ravnotežje premik povzročil.
Dejansko se je izkazalo, da je premik Ravnotežje levo -Spinski označenih dimeri iz lahkih verig, ki posnemajo strukturo FAB-podenot z učinkovanjem 1.2 M NaCl in 0.75 M (NH4) AS04 povečuje stabilnost glede na temperaturo. Podoben premik v ravnovesju med konformerov A in B povzroča druge moti strukturo proteina in njenih hidracijo shell sredstev, kot natrijevega dodecilsulfata in temperaturo.

odvisnost podrejenega stanje IgG po drugih metodah zazna temperaturo. Na primer, G. Troitskii in sodelavci (1971) in J. F. Kiryuhin in sodelavci (1972) z optičnim rotacijskem disperzije opazili reverzibilne odvisna od pH konformacijske spremembe temperature prehoda od 27 ° do 38 °. Nato se je izkazalo, da je v nevtralnem pH območju temperature prehoda ni odvisna od izoelektrične točke IgG.
Vendar, ko pH, oddaljeni od izoelektrične točke, ko je molekula IgG postane dovolj velik lastne stroške, temperature konformacijske prehodi so popolnoma odsotna (Troitsky npr. a., 1973). V VP Zavyalova in osebja (Zavyalov npr. A., 1975) izvedena večplastno raziskave mielom konformacijo proteinov v odvisnosti od pH in temperature optičnih rotacijskem disperzije, krožno dikroizem spektroskopija moteče, elektrokemične jodiranje in diferenčne dinamične kalorimetrije.
Ugotovljeno je bilo, da je pri pH smo spremenili 6,0-6,5 razpoložljivost kromoforne skupine topil zmanjša. To je lahko zaradi sprememb v številu nabitih skupin v proteinu in zmanjšanje intermolekularne elektrostatične sile odbojem. Podoben pojav - zaščitni odsek tirozin in triptofan ostanke (pH 7,35- 0,01 M fosfatni pufer) -nablyudali z naraščajočo temperaturo od 25 do 35 ° C. To pride ob vezavi hapten dinitrofenil homologna kunčje protitelo (IgG) s.
Ti rezultati se lahko šteje za navedbo dejstva, da dvig temperature in nastanek specifičnih kompleksov z haptenov povečuje kompaktnost, ki je v skladu s številnimi del zgoraj navedenih.
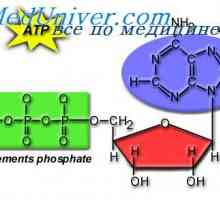 Sproščanje energije iz hrane. Fiziologija adenozin trifosfata (ATP)
Sproščanje energije iz hrane. Fiziologija adenozin trifosfata (ATP)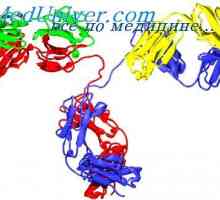 Razredi imunoglobulinov. Struktura imunoglobulinskih verig
Razredi imunoglobulinov. Struktura imunoglobulinskih verig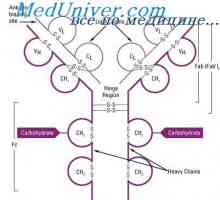 Struktura aktivnih centrov protiteles. Študija aktivnih območij imunoglobulini
Struktura aktivnih centrov protiteles. Študija aktivnih območij imunoglobulini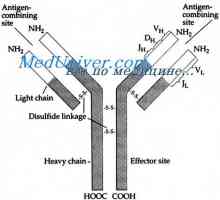 Imunoglobulin središče g. Aktivno Center IgG
Imunoglobulin središče g. Aktivno Center IgG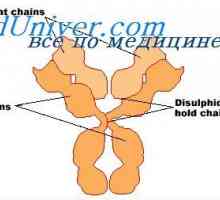 Lastnosti protiteles aktivnih centrov. reaktivnost imunoglobulini
Lastnosti protiteles aktivnih centrov. reaktivnost imunoglobulini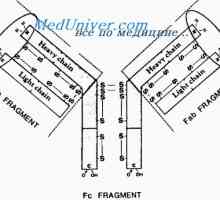 Imunoglobulin reaktivnost. Metoda-spin označene haptenov
Imunoglobulin reaktivnost. Metoda-spin označene haptenov Prilagodljivost imunoglobulina G in e. Fleksibilnosti tipov imunoglobulinov
Prilagodljivost imunoglobulina G in e. Fleksibilnosti tipov imunoglobulinov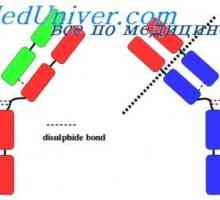 Polarizacija metode fluorescenca protiteles. korelacija imunoglobulina
Polarizacija metode fluorescenca protiteles. korelacija imunoglobulina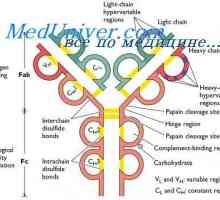 Spremembe molekul protitelesa. Konformacija imunoglobulina
Spremembe molekul protitelesa. Konformacija imunoglobulina Sprememba protitelesa po reakciji z antigenom. dopolnjujejo centri
Sprememba protitelesa po reakciji z antigenom. dopolnjujejo centri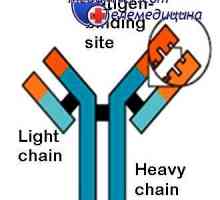 Združenje imunskih kompleksov. Mehanizmi za disociacijo protitelesa-antigen
Združenje imunskih kompleksov. Mehanizmi za disociacijo protitelesa-antigen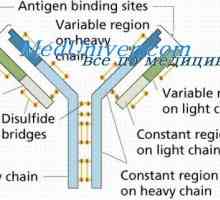 Oborino imunskih kompleksov. Interakcija domene protitelesnih verig
Oborino imunskih kompleksov. Interakcija domene protitelesnih verig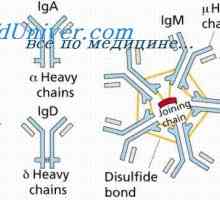 Konformennaya model imunskih kompleksov. Interakcija protiteles z antigeni
Konformennaya model imunskih kompleksov. Interakcija protiteles z antigeni Sinteza imunoglobulinov. tvorbe protiteles
Sinteza imunoglobulinov. tvorbe protiteles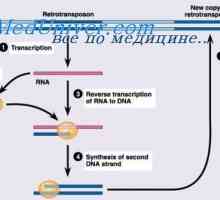 Sinteza imunoglobulin težkih in lahkih verig. Enotna sinteza težke in lahke verige protitelesa
Sinteza imunoglobulin težkih in lahkih verig. Enotna sinteza težke in lahke verige protitelesa Začetna populacija limfatičnih celic. Mozaik celic, protitelesa tvorijo
Začetna populacija limfatičnih celic. Mozaik celic, protitelesa tvorijo Inhibicija tvorbo protiteles. Sinteza protitelesa povratnih
Inhibicija tvorbo protiteles. Sinteza protitelesa povratnih Hipoteza dva signala. interakcija Shema limfocitov T in B
Hipoteza dva signala. interakcija Shema limfocitov T in B Aktivacija model v celicah. indukcija protiteles
Aktivacija model v celicah. indukcija protiteles Diagnoza steroidnih hormonov. metode
Diagnoza steroidnih hormonov. metode Agranulotsitozumenshenie levkocitov. (Manj kot 1000 na 1 l) ali če število granulocitov (manj kot…
Agranulotsitozumenshenie levkocitov. (Manj kot 1000 na 1 l) ali če število granulocitov (manj kot…