Vezivno strukture tkiv, funkcija, sestavek
Vsebina
Video: Human Anatomy & Physiology: Glavne vrste človeškega tkiva. Center za spletno učenje "Foxford"
Značilnosti kemijsko strukturo vezivnega tkiva
Vezno tkivo je do 50% teže človeškega telesa. To je povezava med vsemi tkiv v telesu. Obstajajo 3 vrste vezivnega tkiva:
- dejanska vezivnega tkiva;
- Hrskavičav vezivnega tkiva;
- kostnega vezivnega tkiva
Vezivno tkivo se lahko opravlja kot samostojna funkcija stojalo in vključujejo kot plasti v drugih tkivih.
Funkcije vezivnega tkiva
1. Struktura
2. Zagotavljanje konstantno permeabilnost tkiva
3. Zagotavljanje ravnotežja vodnega soli
4. Sodelovanje pri imunsko obrambo telesa
Sestava in struktura vezivnega tkiva
Vezivno tkivo razlikujemo: medcelične (glavna) SNOV CELL ELEMENTI fibrilacija (kolagenska vlakna). Motiv: intercelularno snov je veliko več kot elementov celic.
Intercelularno (glavni) SNOV
Zdrizasto doslednost osnovnega materiala zaradi svoje sestave. Osnovni material - zelo hidriran gel, ki se tvori z makromolekularne spojine predstavljajo do 30% glede na maso medceličnem snovi. Preostalih 70% - voda.
Visoko molekulsko sestavine so proteini in ogljikovi hidrati. Ogljikovi hidrati v njihovi strukturi so Heteropolisaharidi - GLYUKOZOAMINOGLIKANY (GAG). Te Heteropolisaharidi zgrajene iz disaharidnih enot, ki so njihovi monomerov.
Po monomera struktura razlikuje vrste GAG 7:
1. Hialuronska kislina
2. kondroitin-4-sulfatom
3. kondroitin-6-sulfatom
4. dermatansulfate
5. keratan
6. heparan sulfat
7. Heparin
Monomeri različne GAGi so zgrajene na istem principu. Prvič, njihova struktura vključuje hexuronic kisline: P-D-glukuronska kislina, beta-L-iduronske kisline. V nekaterih GAG namesto beta-D-glukuronske kisline je dalo beta-D-galaktozo:
Druga komponenta je monomer GAG amin. Hexosamines predstavljeni glukozamina in galaktozamin in pogosto njihove acetilni derivati: beta-D-N-acetilglukozamin, beta-D-N-acetilgalaktozamin:

Kot del monomera hexuronic kisline in heksozamina povezana 1,3-beta-glikozidno vez. Izjema - heparin (njegovo alfa-1,3-glikozidno povezavo). Med monomerov 1,4-beta-glikozidno povezavo (heparina - 1,4-alfa glikozidno povezavo) (glej sliko). GAG struktura različnih monomerov in njihove količine, razmerja med njimi.
hialuronska kislina
Molekulska masa tega polimera - do 1.000.000 Da. Monomer izdelana iz glukuronske kisline in N-acetilglukozamin. Znotraj monomera - 1,3-beta-glikozidno povezavo med monomeri - 1,4-beta-glikozidno vezjo. Hialuronska kislina je lahko v prosti obliki in v kompleksnih agregatov. To je edini predstavnik GAG, ki se ne žveplove kisline.
hondroitin sulfat
2 vrsti: kondroitin-4-sulfatom in kondroitin-6-sulfatom. Razlikujejo ostankov ureditev kraj žveplove kisline. Vsi vsebuje ostanke žveplovo kislino. Monomer hondroitin sulfat izdelana iz glukuronske kisline in N-atsetilgalaktozaminsulfata. Najdeno v vezi v sklepih in tkiv zoba.
dermatansulfate sulfat
Njena monomera je izdelana iz iduronske kisline in galaktozamin-4-sulfatom. Bil je eden od strukturnih sestavin hrustanca tkiva.
keratan sulfat
Monomera keratan sulfat sestavljena iz galaktoze in N-acetilglukozamin-6-sulfatom.
Heparan sulfat in heparina
So zelo sulfatiranega (monomer 2-3 ostanek žveplove kisline). Sestavek sestavljen iz glukuronat-2-sulfat in N-acetilglukozamin-6-sulfatom.
Dolge polisaharidov verige se oblikujejo v kroglic. Vendar pa te globule ohlapne (nimajo kompaktno zlaganje) in zasedajo relativno velik obseg. GAGi so hidrofilne spojine, ki vsebujejo več hidroksilnih skupin, ki imajo znatno negativen naboj (več karboksilnih in sulfo skupine). Pomemben negativni naboj spodbuja upoštevanje nanj pozitivno nabiti kationi kalija, natrija, kalcija, magnezija. To dodatno poveča sposobnost zadrževanja vode ter spodbuja disociacijo molekul teh snovi v vezivnem tkivu.
GAGi so del kompleksa proteinov imenovano proteoglikani. GAG da proteoglikane v 95% njihove teže. Preostalih 5% teže - to je protein. Beljakovine in ne-proteinske komponente proteoglikani so vezani z močnimi, kovalentne vezi. Kako je proteoglikan molekula?
Proteinska komponenta - to je posebno COR-proteina. Za njim uporabljajo trisaharidov pridružijo GAG. COR-1 molekula proteina lahko vežejo do 100 GAG.
V celici se proteoglikani povezana s hialuronsko kislino. Oblika kompleksne supramolekularnih kompleksov. Sestavljena je iz hialuronske kisline, specifične vezavne proteine in proteoglikani. Elastični GAG verige, sestavljene iz proteoglikanov tvorijo makromolekularnp oblika razvejane strukture. Takšna kemijska sestava zagotavlja funkcijo molekularnimi siti s posebnimi velikosti por na različnih prometnih snovi in metabolitov. Velikost por je odvisna od tipa GAG prevladuje v določenem tkivu. Na primer, vezno kapsula ledvična glomerulih omogoča selektivno transport snovi v procesu ultrafiltracije. Zaradi množice sulfo in karboksilnih skupin polyanions mrežast struktura lahko nanašanje vode, nekatere katione (K +, Na +, Ca + 2, Mg + 2).
Poleg proteoglikani, glikoproteini vsebuje osnovno snov.
glikoproteini
Njihova ogljikohidratna komponenta - je oligosaharid obsega 10 - 15 monomernih enot. Te monomernih enot so večinoma manjše monosaharidi: manoza, fukoze in metilpentozy ramnozo, arabinozo, ksiloza. Na koncu tega obstaja druga oligosaharida izpeljanih monosaharidi: sialne kisline (acil derivat nevraminske kisline). Če koncentracija sialne kisline v krvi poveča - zato je razpad ekstracelularnega matriksa. To se zgodi v času vnetja.
Glikoproteini se delijo v 2 skupini:
1. topen
2. netopen.
delež ogljikovih hidratov glikoproteinov je zelo spremenljiva. Pomembno je zaporedje monosaharidi, kot tudi zaporedje aminokislin v delu proteina. Glikoproteinov po najbolj raziskana topnih in netopnih laminina, fibronektina.
TOPEN glikoprotein zlasti beljakovin - fibronektin. Molekulska masa fibronektina - 440 kDa. Sestoji iz dveh polipeptidnih verig, povezanih z disulfidnim mostom. To je vezavna mesta z proteoglikanov, s vlaknenih struktur, glikolipidov celičnih membran. Zato se imenuje fibronektin "molekulska lepilo". To se običajno nahaja na površini fibroblastov in sodeluje pri lepljenje vseh teh celičnih struktur, in, posledično, celica. Znano je, da ko se količina tumorjev fibronektina zmanjša, kar pospešuje metastaze tumorja.
Z topnih glikoproteinov tudi COR-protein - a proteoglikan komponento, vezavnih proteinov, in število krvnih plazemskih proteinov.
Netopne glikoproteini form "okvir". "STROMA" zunajceličnega matriksa.
Z netopnih glikoproteinov vključujejo laminin. Molekulska masa proteina - 10,000 kDa. Vsebuje enake ogljikohidratnih komponent, kot so gangliozidi in celične membrane.
Komponente ogljikovih hidratov glikoproteinov ter glikoproteinov in ogljikohidratnih komponent imajo lastnosti tkivnim antigenom.
Katabolizem COMPONENTS osnovne snovi
To je pod vplivom nekaterih hidrolaze.
Na primer, glikoproteinov nevraminidaze cepi iz N-acetilnevraminska (sialne) kislino in so destabilizacije glikoprotein makrofagi absorbira. Zato je koncentracija v krvi sialne kisline - značilnost stanja veznega tkiva. Ta koncentracija je pri vnetnih procesih precej povečala.
Ko odpoved katabolni encimov osnovna snov razvoj bolezni - mukopolisaharidoze, na katerih kopičenje v tkivih različnih GAG.
Vezivnega tkiva vlaken
V ekstracelularnega matriksa 2 vrsti vlaknenih struktur: kolagena in elastina vlakna. Njihova glavna komponenta netopna protein kolagen.
KOLAGEN - proteinski kompleks nanaša na skupino glikoproteinov kvarterni strukturo, njegova molekulska masa je 300 kDa. To je 30% celotnega proteina v človeškem telesu. Njegova fibrilarnega obliko - ovito vijačno ki sestoji iz 3-alfa verige. Netopen v vodi, raztopinah soli, razredčene raztopine kisline in baze. To je posledica primarne strukture kolagena. Pri 70% kolagena aminokislin hidrofoben. Aminokislin v polipeptidni verigi razporejena v skupine (triad) podobni drug drugemu v strukturi, ki sestoji iz treh aminokislin. Vsak tretji amino kislina v primarne strukture kolagena - glicin (triado (ali skupine): (Gly-X-Y) n, pri čemer je X - katera koli aminokislina ali hidroksiprolin, Y - je katera koli aminokislina ali hidroksiprolin ali hidroksilizin). Te amino skupine v polipeptidni verigi se ponavljajo. Nenavadno in sekundarna struktura kolagena: Stopnja ena tuljava vrsti predstavlja samo 3 aminokisline (še malo manj kot 3) namesto 3,6 aminokisline na 1 krog, kot je bilo v drugih proteinov. To tesen spiralo zavijanje zaradi prisotnosti glicina. Ta funkcija določa zgornjo strukturo kolagena. Molekula kolagena je izdelana iz 3-verig in je trojna vijačnica. Ta trojna vijačnica je sestavljena iz 2 alfa1 verig in eno alfa2 verige. V vsaki verigi 1000 aminokislinskih ostankov. Verige so vzporedno in imajo nenavadno razporejenosti videl: nahajajo izven hidrofobnih amino ostanki. Obstaja več vrst kolagena, genetsko različni.
sintezo kolagena
Obstaja 8 stopnje biosinteze kolagena: 5 znotraj celic in 3 zunajcelični.
1. faza
To se zgodi na ribosomov sintetizirana molekula prekurzor: preprokollagen.
2. faza
Uporaba signalnega peptida &ldquo-pre&rdquo- prevoz molekula v cevkah v endoplazemski retikulum. Tam je razklan "pre" - oblikovala "prokolagena".
3- STOPNJA
aminokislinski ostanki lizina in prolina v sestavi kolagenskih molekul se oksidirajo z encimi prolil in lizil hidroksilazo (ti oksidativni encimi so monooksigenaz podpodklassu) (glej sliko). Pomanjkanje vitamina "C" - askorbinske kisline se pojavi skorbut, - bolezni z napako sintezo kolagena z nizko mehansko trdnost, ki povzroča, zlasti rahljanje od žilne stene in drugim neugodnim pojave, povzročene.
4. etapa
Posttranslacijska modifikacija - glikozilacijsko z encimom glikozil transferazo v prokolagena. Ta encim prenese glukoze ali galaktoze na hidroksilni skupini hidroksilizin.
5. etapa
Končna intracelularni faza - je tvorba trojne vijačnice - tropocollagen (topnega kolagena). V okviru pro-zaporedja - cisteinu amino kisline, ki tvori disulfidno vez med verigami. Postopek vijačnice.
6. etapa
Tropocollagen se izloča v zunajcelični medij, kjer je amino in karboksiproteinazy odcepimo (pro -) - sekvenco.
7. etapa
Kovalentna "šivi" tropocollagen načelu "konca do konca", da se tvori netopna kolagena. V tem postopku delu leži encim lizil oksidaza (flavometalloprotein vsebuje FAD in Cu). Oksidacija se zgodi in ostanek deaminacijo lizina, da se tvori aldehidno skupino. Nato med njima obstaja aldehidne ostanki lizin vezjo. Šele po večkratni navzkrižno povezovanje kolagenskih vlaken prevzame svojo edinstveno moč, da postane ne-raztegljiva vlaken. Lizil oksidaza je Cu odvisnega encim, tako da pomanjkanje bakra v telesu zmanjša moč vezivnega tkiva zaradi znatnega povečanja količine topnega kolagena (tropocollagen).
8. etapa
Zveza molekul netopen kolagena na "strani strani do". Zveza med vlaken izvedemo tako, da je vsaka zaporedna niz premakne za 1/4 njegove dolžine glede na prejšnji vezja.
elastična vlakna
2. vrsta vlaken - elastična. Struktura osnove - protein elastin. Elastin je bolj hidrofoben kot kolagen. To do 90% hidrofobne aminokisline. Veliko lizina, obstajajo območja z natančno definirano sekvenco aminokislin. Verige so zložene v prostoru v obliki kroglic. Globulo ene same polipeptidne verige imenujemo alfa elastin. Zaradi ostankov lizina interakcije med molekulami alfa-elastina.
Pri oblikovanju te strukture so vključene lizin ostanki amino kislin. Ta struktura desmosine. Desmosine - piridin strukturo, ki je tvorjena z reakcijo 4-lizin-alfa elastina molekule.
Celični elementi vezivnega tkiva.
To fibroblasti, mastociti in makrofagov. Pri teh postopkih se pojavijo sintezo strukturnih komponent in obdelamo porazdelitev vezivnega tkiva. Kolagen je posodobljen za 50% v 10 letih. Za fibroblaste so sintetične postopke: elastinom.
Video: epitelnih in vezivnega tkiva
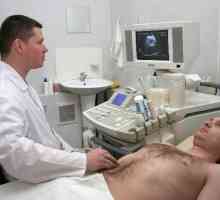 Difuzna spremeni strukturo trebušne slinavke
Difuzna spremeni strukturo trebušne slinavke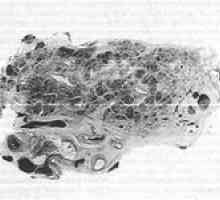 Stromalni komponente trebušna slinavka
Stromalni komponente trebušna slinavka Vezivno tkivo zarodka. Vlaknenih in elastično vezivno tkivo zarodka
Vezivno tkivo zarodka. Vlaknenih in elastično vezivno tkivo zarodka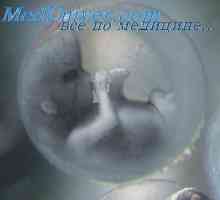 Zarodka vezivno plast kože. nohti na zarodek
Zarodka vezivno plast kože. nohti na zarodek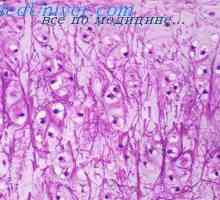 Histogeneze kosti zarodka. Membranasta kosti plod
Histogeneze kosti zarodka. Membranasta kosti plod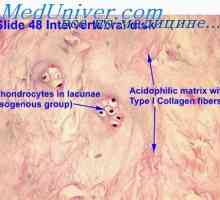 Nastanek trabekularna kost v zarodek. Pojav endochondral kosti plod
Nastanek trabekularna kost v zarodek. Pojav endochondral kosti plod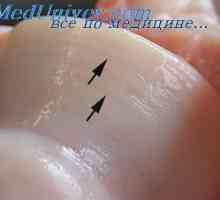 Skupni razvoj zarodka. Oblikovanje sklepov zarodkov
Skupni razvoj zarodka. Oblikovanje sklepov zarodkov Prosti in inkapsulirane živčnih končičev v zarodka. živčnomišična konec
Prosti in inkapsulirane živčnih končičev v zarodka. živčnomišična konec Izvor krvnih celic. tkiva retikuloendotelijskega plodu
Izvor krvnih celic. tkiva retikuloendotelijskega plodu Osifikacijo lobanje ploda. Oblikovanje lobanje zarodka
Osifikacijo lobanje ploda. Oblikovanje lobanje zarodka Echinococcus ščitnice
Echinococcus ščitnice Metastatski ščitnice adenom. Sarkoma ščitnice
Metastatski ščitnice adenom. Sarkoma ščitnice Čiščenje telesa toksinov
Čiščenje telesa toksinov Čiščenje glavnih vrst človeških tkiv
Čiščenje glavnih vrst človeških tkiv Sistemska sklerodermija. Klasifikacija, etiologija, patogeneza
Sistemska sklerodermija. Klasifikacija, etiologija, patogeneza Zakaj tuš Alekseeva skoraj 100% zagotovljeno, da se znebite hernija diska
Zakaj tuš Alekseeva skoraj 100% zagotovljeno, da se znebite hernija diska Vezivnega tkiva
Vezivnega tkiva Dihanje. Dihala. Funkcije dihalnega sistema.
Dihanje. Dihala. Funkcije dihalnega sistema. Jakost usposabljanje za močnejše kosti in vezivnega tkiva
Jakost usposabljanje za močnejše kosti in vezivnega tkiva Zdravje Enciklopedija, bolezni, zdravila, zdravnik, lekarna, okužba, povzetki, spol, ginekologije,…
Zdravje Enciklopedija, bolezni, zdravila, zdravnik, lekarna, okužba, povzetki, spol, ginekologije,… Zdravje Enciklopedija, bolezni, zdravila, zdravnik, lekarna, okužba, povzetki, spol, ginekologije,…
Zdravje Enciklopedija, bolezni, zdravila, zdravnik, lekarna, okužba, povzetki, spol, ginekologije,…