Osmotski tlak. Osmolarnost, in boš
Če so izpolnjeni pogoji za raztopino natrijevega klorida
Vsebina
Video: molarnost primerjavi osmolarnosti
Načelo razlike tlak, nasprotnih osmozo, je prikazana na sliki, je prikazan selektivno membrano, ki ločuje dva tekočega kolono, od katerih ena vsebuje čisto vodo, in drugo - vodo in vsako topljenca, ne prodirajo skozi membrano.
Osmoza voda iz predelka B Predel vodi k povečanju nivojev tekočin znižala na stebrih, dokler sčasoma tlačne razlike na obeh straneh membrane ne bo dovolj velika, da se uprejo osmotsko učinek. Razlika tlakov preko membrane v tem trenutku je enaka osmotskega tlaka raztopine, ki ne vsebuje prodirajo skozi membranski material.
vrednost znašajo osmotske delce (Koncentracija Molska) v definiciji osmotskega tlaka. Osmotskega tlaka, ki ga ustvarijo raztopljenih delcev, ne glede na to, ali so molekule ali ioni, s številom delcev na enoto volumna tekočine določeni, ne pa tudi mase, ker vsak delec v raztopini, ne glede na njegovo težo, deluje enako pritiska na membrano v povprečju.

Na primer, veliki delci, ki ima veliko maso (m) in se premika pri nižji hitrosti (v), kot majhne delce. Majhni delci premikajo z veliko hitrostjo in povprečno kinetično energijo (k), definirano z enačbo: k = MV2 / 2, je enak za vse majhne in velike vsak delec. Zato je determinanta osmotskega tlaka raztopine je njena koncentracija, izražena v številu delcev (navedene nedissotsiiruyuschih snovi podobno koncentracijo molski), vendar ni merilo mase topljenca.
osmolarnost. Osmol. Pri določanju koncentracijo raztopine v smislu števila delcev se uporabljajo namesto gramov enoto imenovano osmolarnosti.
Video: Oyster. Micelij. Rešitve za shranjevanje pridelkov. osmolarnost
ena osmol je 1 gram molekula osmotsko aktiven topljenca. Tako, 180 g glukoze, t.j. 1 mol glukoze enako 1 glukozo osmol ker glukoza ne disociira v ione. Če raztopina ionske disociira na 2, bo 1 gram molekul topljenca ustrezajo osmol 2, saj je število osmotsko aktivnih delcev v tem primeru je dvakratnik za nedissotsiiruyuschego snov.
na polno disociacija 1 mol natrijevega klorida ali 58,5 g, kar ustreza 2 osmolarnosti.
Zato je raztopino, ki vsebuje 1 osmol topljenca v vsaki kilogram vode, recimo njegova osmolarnost je 1 osmol do 1 kg. Raztopina vsebuje topljenca osmolarnost 1/1000 do 1 kg, ima osmolalnost 1 milliosmol (mOsm) na 1 kg. Normalna osmolarnosti zunajcelične in znotrajceličnih tekočinah je približno 300 mOsm na 1 kg vode.
Sporočilo osmolarnost z osmotskega tlaka. Pri 37 ° C, npr pri temperaturi od normalne telesne temperature, raztopino s koncentracijo 1 osmol do 1 litra vode ustvarja osmotski tlak, ki je enaka 19300 mm. Hg. Art. Zato je koncentracija 1 moj na 1 liter je enako 79,3 mm. Hg. Art. osmotski tlak.
Razmnoževanje te vrednosti 300 mOsm, t.j. koncentracija delcev v telesnih tekočinah daje oceno skupnih osmotski tlak 5790 mm Hg. Art., Vendar je dejanska vrednost izmerjenega tlaka v povprečju le 5.500 mm Hg. Art. Razlog za to razliko je v tem, da so mnogi izmed ionov v telesnih tekočinah, npr natrijeve in klorove ione, močno privlačijo med seboj in zato ne more gibati popolnoma prosto, izvaja svoj polni osmotski potencial.
V zvezi s tem, Res osmotski tlak telesnih tekočinah povprečje približno 0,93 (93%) od izračunane vrednosti.
Izraz "osmolarnost". Zaradi kompleksnosti merjenja vode v raztopini v kilogramih, da je treba določiti osmolarnost, namesto tega indeksa se uporablja osmolarnost, tj osmolarnostjo koncentracija, izražena kot število daubed 1 liter raztopine, in ne števila osmolarnosti na 1 kg vode. Čeprav, strogo gledano, da boš na 1 kg vode (osmolarnosti) za določanje osmotskega tlaka takih razredčenih raztopin za telesni tekočini, količinske razlike med osmolarnosti in osmolarnosti manj kot 1%.
Ker ukrepa osmolarnosti lažje kot osmolarnosti, to je običajna praksa v skoraj vseh fizioloških študij.
 Diagnoza in prva pomoč v paroksizmalno atrijsko fibrilacijo in plapolanja
Diagnoza in prva pomoč v paroksizmalno atrijsko fibrilacijo in plapolanja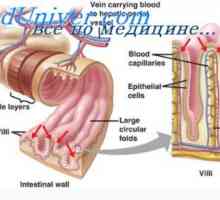 Absorpcija vode v tankem črevesu. Fiziologijo absorpcije ionov v črevesju
Absorpcija vode v tankem črevesu. Fiziologijo absorpcije ionov v črevesju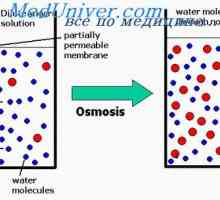 Nernstov potencial. Difuzijski osmozo
Nernstov potencial. Difuzijski osmozo Kontrtransport kalcijeve in vodikovi ioni. Aktivni transport v tkivih
Kontrtransport kalcijeve in vodikovi ioni. Aktivni transport v tkivih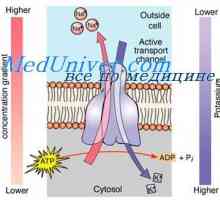 Membranski potencial. Difuzijski potenciali celice
Membranski potencial. Difuzijski potenciali celice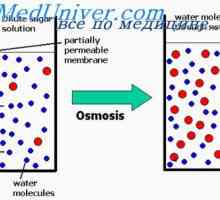 Razmerje med osmotskega pritiska in osmolarnosti. Osmolarnosti telesnih tekočin
Razmerje med osmotskega pritiska in osmolarnosti. Osmolarnosti telesnih tekočin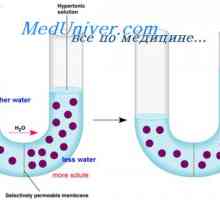 Uredba o izmenjavi tekočin. Osmoza in osmotski tlak
Uredba o izmenjavi tekočin. Osmoza in osmotski tlak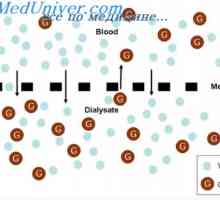 Vzdrževanje osmotsko ravnotežje. Osmotsko ravnotežje telesnih tekočin
Vzdrževanje osmotsko ravnotežje. Osmotsko ravnotežje telesnih tekočin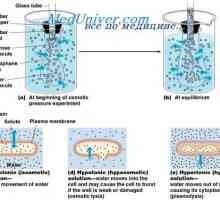 Obseg in osmolarnost telesnih tekočin v patologiji. Učinki infuzije natrijevega klorida
Obseg in osmolarnost telesnih tekočin v patologiji. Učinki infuzije natrijevega klorida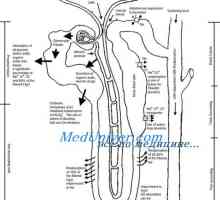 Pasivna reabsorpcijo vode v ledvicah. Pasivni reabsorpcijo kloridnih ionov, sečnina ledvic
Pasivna reabsorpcijo vode v ledvicah. Pasivni reabsorpcijo kloridnih ionov, sečnina ledvic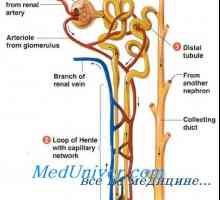 Tlak v ledvičnega parenhima. Presorski mehanizmi natriurezo in diureze
Tlak v ledvičnega parenhima. Presorski mehanizmi natriurezo in diureze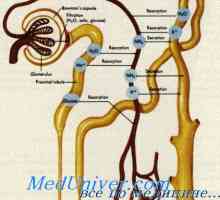 Ledvica peritubulne kapilare. Ureditev ponovno absorbirajo v peritubulne kapilar
Ledvica peritubulne kapilare. Ureditev ponovno absorbirajo v peritubulne kapilar Oskrbovanje v akutno odpovedjo desno prekata (akutni pljučni srce)
Oskrbovanje v akutno odpovedjo desno prekata (akutni pljučni srce) Osmolarnost
Osmolarnost Poliglyukin (rolyglucinum). Sterilna 6% raztopina srednjih frakcij delno hidrolizirani dekstran…
Poliglyukin (rolyglucinum). Sterilna 6% raztopina srednjih frakcij delno hidrolizirani dekstran… Reomakrodeks (rheomacrodex) *. Tuji drog blizu polyglukin in njegovih analogov. Raztopino, ki…
Reomakrodeks (rheomacrodex) *. Tuji drog blizu polyglukin in njegovih analogov. Raztopino, ki… Locke zvonca (REŠITVE natrii chloridi composita-REŠITVE zvonjenje Locke). Sestava: 9 g natrijevega…
Locke zvonca (REŠITVE natrii chloridi composita-REŠITVE zvonjenje Locke). Sestava: 9 g natrijevega… Izotonična natrijevega klorida za injekcije (REŠITVE natrii chloridi isotonica Pro injectionibus).…
Izotonična natrijevega klorida za injekcije (REŠITVE natrii chloridi isotonica Pro injectionibus).… Gigrony (nugronium). ~ -dimetilaminoetilovogo estra N-metil-pirolidin karboksilne kisline…
Gigrony (nugronium). ~ -dimetilaminoetilovogo estra N-metil-pirolidin karboksilne kisline… Velika Medical Encyclopedia IC nevronet. droge
Velika Medical Encyclopedia IC nevronet. droge Hematologije, plazme
Hematologije, plazme