Kislinsko-bazično ravnovesje. Ureditev koncentracijo vodikovih ionov
Video: kislinam titracija - Postopek za določevanje koncentracije kisline ali baze v raztopino
Vsebina
mehanizmi uravnavanja vsebnost vodikovih ionov (H +) v telesu v mnogih pogledih podobni vzdrževanju ravnotežja drugih ionov. Na primer, da bi dosegli homeostazo potrebno korespondenco med prihoda (Oblika) H + ionov in jih izoliramo iz organizmov ma. Ledvice vodilno vlogo pri odpravljanju ionov iz telesa Hm. Natančna regulacija vsebnosti H + v zunajcelični tekočini ni le razporediti svoje ledvice. Poleg tega v telesu več različnih mehanizmov puferska s katero je koncentracija H + ionov v fluidni medij vzdržujemo pri normalni urovne- jih vključujejo krvni sistem, dihala in procese, ki se pojavljajo na ravni celice.
Video: Kislinsko-titracija
V tem članku vloga različnih dejavnikov, ki prispevajo k ohranjanju določene koncentracije H + ionov. V to posebno vlogo reabsorpcijo in izločanje H + ionov v tubul, kot tudi tvorbo in izločanje bikarbonata (HCO3-) preko ledvic, ker te snovi v glavnem določitev statusa kislinsko-bazično ravnovesje v tekočem mediju.
točen Uredba o vsebini H + ionov To je zelo pomembno, saj je koncentracija ionov vpliva na delovanje skoraj vseh encimskih sistemov v telesu med. V zvezi s to spremembo v njihovi vsebini vpliva na skoraj vse funkcije celic in telesa.
Video: Rešitev na "soli Hidroliza" №7

V primerjavi z drugimi ionov H + koncentracija ionov v tekočem gojišču običajno vzdržujemo na nizkem nivoju. Na primer, koncentracija natrija v ekstracelularni tekočini (142 meq / l) je skoraj 3,5 milijona krat večja od vsebnosti H + ionov, za katere povprečja 0,00004 meq / l. Normalno območje za H + ionov je prav tako del razpon 1/106 ionski nihanj Na +, tako da se ohrani številne celične funkcije potrebno kontrolirati vsebnost H + ionov z visoko natančnostjo.
H delcev (Proton) je del molekule vodika. Molekule, ki lahko odrinejo da se tvori H + ionov, imenovanih kislin. Primer take spojine - klorovodikova kislina (HCI), ki disociira v vodi v vodikovih ionov (H +) in kloridni ion (Cl-). Takšna disociacija pojavlja v molekuli in ogljikove kisline (H2CO3), kar ima za posledico tvorbo H + ionov in bikarbonata (NPHS).
Razlogi, navedeni ioni ali molekule, so sposobni vezave proton. Baza je na primer, lahko šteje HCO3, saj je bikarbonat ionska lahko združijo s H + ioni, da se tvori H2CO3. Bikarbonatnih ionov kot fosfat (HPO4), kot so osnove: pritrditev proton, tvorijo N2R04. Proteini v telesu deluje tudi kot bazo kot nosijo negativen naboj in lahko vežejo H + ione. Najpomembnejši med njimi so hemoglobina rdečih krvnih celic in znotrajceličnih beljakovin.
Izraza "razlogi"In"lugi"Ali se pogosto uporabljata kot sopomenki. Alkalijske je molekula, ki vključuje eno ali več alkalijskih kovin - natrij, kalij, litij, in podobno, in močna baza, kot je na primer hidroksilnih ionov (OH-) .. Nekatere od teh molekul z osnovnimi zastopa hitro reagira z ioni H + v raztopini ju povezuje, tako alkalna nanašajo na tipičnih razlogov. Pomanjkanje protonov v tekočih medijih iz alkaloza, in presežek - acidozo.
 Fiziologija sline. izločanje sline
Fiziologija sline. izločanje sline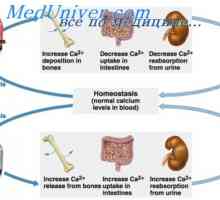 Učinek obščitničnega hormona v črevesju. Ureditev izločanje obščitnic hormona
Učinek obščitničnega hormona v črevesju. Ureditev izločanje obščitnic hormona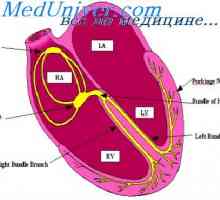 Komunikacija med vzbujanja in krčenje srca. Vloga kalcijevih ionov v krčenje srca
Komunikacija med vzbujanja in krčenje srca. Vloga kalcijevih ionov v krčenje srca Kalijev sekrecijski primarne ledvične celice. Dejavniki reguliranje izločanja kalija
Kalijev sekrecijski primarne ledvične celice. Dejavniki reguliranje izločanja kalija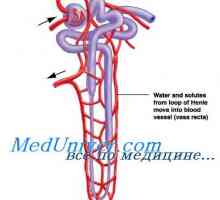 Vpliv acidoze kalijevega izmenjavi. Mehanizmi, ki urejajo koncentracijo kalcija
Vpliv acidoze kalijevega izmenjavi. Mehanizmi, ki urejajo koncentracijo kalcija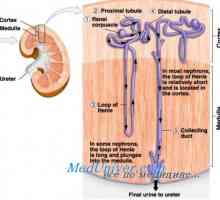 Učinek aldosterona kalijevega izmenjavi. Odvisnost kalijev izločanje aldosterona
Učinek aldosterona kalijevega izmenjavi. Odvisnost kalijev izločanje aldosterona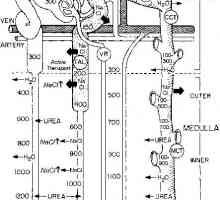 Sodelovanje v zameno ledvic magnezija. Nastavitev glasnosti intersticijske tekočine
Sodelovanje v zameno ledvic magnezija. Nastavitev glasnosti intersticijske tekočine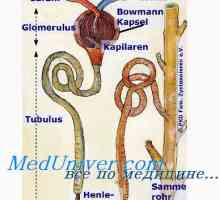 Vzdrževanje koncentracijo vodikovih ionov. Funkcija varovalnih sistemov
Vzdrževanje koncentracijo vodikovih ionov. Funkcija varovalnih sistemov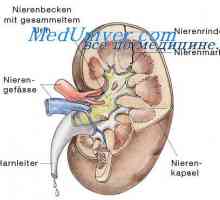 Močne in šibke kisline in baze. Koncentracija vodikovih ionov in pH
Močne in šibke kisline in baze. Koncentracija vodikovih ionov in pH Sekrecijo v ledvicah protonov. Reabsorpcijo bikarbonata ionov skozi ledvice
Sekrecijo v ledvicah protonov. Reabsorpcijo bikarbonata ionov skozi ledvice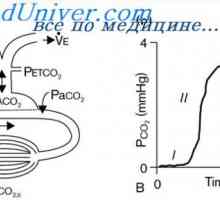 Pufer zmogljivost respiratornega sistema. Sodelovanje pri ledvični regulaciji kislinsko-bazično…
Pufer zmogljivost respiratornega sistema. Sodelovanje pri ledvični regulaciji kislinsko-bazično…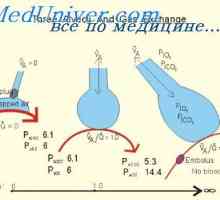 Vpliv alveolarne prezračevanja od pH. V odvisnosti od pH na dihala
Vpliv alveolarne prezračevanja od pH. V odvisnosti od pH na dihala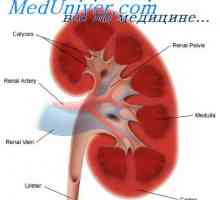 Nevtralizacijo ledvice protoni. Osnovni mehanizem izločanja aktivnega vodikovih ionov ledvico
Nevtralizacijo ledvice protoni. Osnovni mehanizem izločanja aktivnega vodikovih ionov ledvico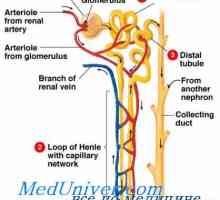 Odvisnost izločanja preko ledvic protonov. Mehanizmi izločanja proton v ledvičnih cevkah
Odvisnost izločanja preko ledvic protonov. Mehanizmi izločanja proton v ledvičnih cevkah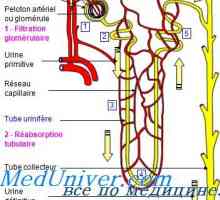 Popravek alkaloza ledvice. Mehanizmi ledvic popravek alkaloze
Popravek alkaloza ledvice. Mehanizmi ledvic popravek alkaloze Mehanizem nastajanja novih bikarbonatnih ionov. Fosfatni pufer ledvična sistem
Mehanizem nastajanja novih bikarbonatnih ionov. Fosfatni pufer ledvična sistem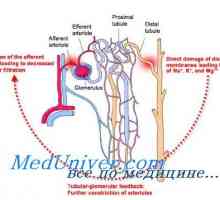 Popravek acidoze ledvice. Mehanizmi ledvic popravka acidozo
Popravek acidoze ledvice. Mehanizmi ledvic popravka acidozo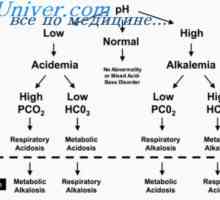 Amonijev puferski sistem. Količinska kislin in baz dodelitve
Amonijev puferski sistem. Količinska kislin in baz dodelitve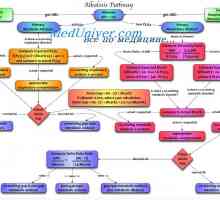 Vzroki za presnovno alkaloze. Zdravljenje acidozo in alkaloza
Vzroki za presnovno alkaloze. Zdravljenje acidozo in alkaloza Aktivnost respiratornega centra. Kemična regulacija dihanja
Aktivnost respiratornega centra. Kemična regulacija dihanja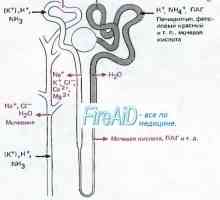 Acidoza ledvičnih tubulov. Proksimalnokanaltsevy
Acidoza ledvičnih tubulov. Proksimalnokanaltsevy